Микробиолог Стэн Броунс изучает вековую битву между вирусами и бактериями. Их раса возродила старую терапию для борьбы с инфекциями. «Мы могли бы быть в начале революции».
Несколько раз в год Стэн Броунс (1978 г.) ходит на станцию очистки сточных вод, чтобы взять пробы. Он понимает, что для многих людей нести домой ведра с нечистотами не очень приятно, но для него это золотая жила. «У каждого из нас в кишечнике находится полкило бактерий. Это миллиарды. Часть из них попадает в сточные воды. Эти образцы содержат не только бесчисленные варианты человеческих бактерий, но и их естественных врагов, бактериофагов», — говорит профессор микробиологии Делфтского технического университета. «В прошлом году мы открыли целое новое семейство фагов, которое назвали в честь знаменитого жителя Делфта Антони ван Левенгука».
Браунс видит в этих естественных врагах медицинское применение: борьба с бактериальными инфекциями. Обычно для этого врач прибегает к антибиотикам, но некоторые бактерии выработали устойчивость к этому панацею. В этом случае бактериофаг может принять бой. Но это еще не разрешено в Нидерландах. Эффективность и безопасность фаготерапии пока клинически не доказаны. А пока Браунс уже создает базу данных бактериофагов, насколько он знает, насколько они могут быть эффективны. В его коллекции сейчас 150 экземпляров.
На этой неделе было объявлено, что Браунс стал одним из восьми лауреатов научной премии Аммодо. Премия является признанием его научных исследований. Браунс потратит соответствующую сумму денег, 350 000 евро, на расширение своей коллекции фагов.
Каждый день бактериофаги убивают треть всех бактерий в океане
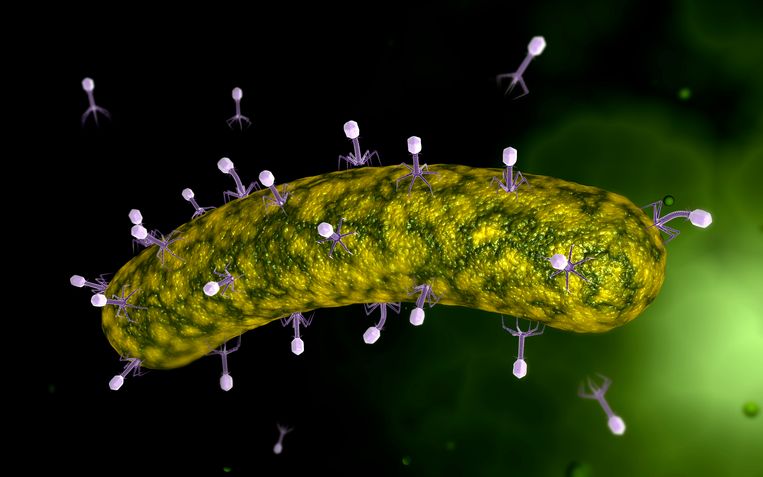
Бактериофаги представляют собой группу вирусов, поражающих бактерии. Каждый день бактериофаги убивают треть всех бактерий в океанах. Но фаги очень разборчивы. Существует много типов бактерий, и у каждого типа есть много вариантов. Но каждый бактериофаг может заражать только один тип бактерий или, самое большее, несколько вариантов.
Они похожи на лунный посадочный модуль, говорит Браунс. Капсула на длинных ножках с хвостиком между ними. Браунс: «Как только фаг нашел подходящую бактерию, приземлился на нее и все подходит, он вставляет свой хвост и под высоким давлением вводит свою ДНК в клетку-хозяина. Лопнет, как бутылка шампанского. ДНК фага берет на себя функции бактериальной клетки и создает как можно больше своих копий. Если это удастся, бактерии погибнут».
Уже более века известно, что бактериофаги можно использовать против бактериальных инфекций. Во многих странах терапия канула в лету из-за появления антибиотиков, но в Грузии она до сих пор практикуется, а в Бельгии и Польше, например, фаги снова на подъеме. Главный недостаток в том, что они очень специфичны. Вы не можете использовать их при острой инфекции, говорит Браунс. «Сначала вам придется узнать на чашке Петри, какой бактериофаг эффективен. Вы делаете это только в случае хронической инфекции, против которой, похоже, не действуют никакие антибиотики».
Эффективность трудно доказать
Второй недостаток заключается в том, что их эффективность трудно доказать. Большое клиническое испытание, в котором половина пациентов с инфекцией получает бактериофаг, а другая — плацебо, обречено на провал. У всех этих больных есть варианты бактерии, с которыми нельзя бороться одним и тем же бактериофагом. По словам Броунса, до сих пор невозможно собрать группу с одинаковыми бактериями.
Между тем, есть много исследований, которые защищают бактериофаги. Описания отдельных больных, излеченных с помощью фагов, убедили самого Броунса. Но он оставляет это дело врачам. «Научное объяснение их эффективности и безопасности убедительно, но нас не интересуют клинические данные. Мы просто создаем эту коллекцию. Цель состоит в том, чтобы найти серию фагов для десяти или около того видов бактерий, которые представляют проблему в больницах из-за их устойчивости».
В своих фундаментальных исследованиях он больше фокусируется на бактерии: как она защищается от бактериофага? Два микроорганизма участвуют в гонке вооружений на протяжении миллиардов лет. Фаг атакует, бактерия вырабатывает защиту, которую фаг затем пытается избежать. Это борьба не на жизнь, а на смерть. У бактерий есть всего несколько минут, чтобы распознать и бороться с ДНК вируса.
Защитные механизмы
В ходе этой многовековой эволюции бактерия приобрела все виды защитных механизмов, чтобы держать фагов в страхе. Эти линии также препятствуют фаготерапии. Браунс недавно получил крупную европейскую субсидию, грант ERC, на поиск таких препятствий.
Но не является ли гонка вооружений между бактерией и ее врагом предвестником сопротивления? Если эволюция разработала защиту от каждой атаки фага, то лекарство на основе фага, по-видимому, быстро изнашивается. Браунс этого не боится. «Эти линии существуют уже миллиарды лет. Бактерии смогли построить такой банк памяти, потому что некоторые из них пережили атаку и смогли ее заархивировать. Это приложение мало что меняет. Кроме того, многие болезнетворные бактерии не используют этот прием. А если бактериофаг уже не работает, можно поискать новый. В природе до сих пор существует бесчисленное множество фагов, которых такая бактерия не знает».
Собираем супербактериофаг
В свою очередь, бактериофаги также научились всевозможным уловкам, чтобы уклоняться от защиты. «Мы могли бы собрать эти трюки и внедрить их в существующие фаги. Вполне возможно, что мы сможем создать супербактериофаг, который не станет устойчивым так быстро. Но, если честно, мы до сих пор недостаточно хорошо понимаем генетическую информацию».
Даже бактерии одного и того же вида не имеют одинаковой внешности, объясняет Браунс. «Если вы хотите создать эффективный бактериофаг, вам нужно точно знать, что важно для такого фага. В настоящее время мы можем проверить это намного быстрее на чашке Петри. Один работает, а другой нет? Тогда мы продолжим с этим. Это относится и к внутреннему: какая защита у бактерии и какой фаг знает, что с ней делать, а какой нет? Лучше проверить это, чем пытаться предсказать».
Около двадцати лет назад ученые обнаружили, что некоторые бактерии отслеживают, кто на них напал. Оказалось, что генетический код этих бактерий содержит странные фрагменты ДНК, ДНК вируса. Это банк памяти, говорит Браунс. Это позволяет бактериям действовать быстро.
«Помните, что клетка заполнена тысячами молекул: собственной ДНК или РНК, питательными веществами, белками. Это должно оставить бактерии нетронутыми. С этим фрагментом чужеродной ДНК он обыскивает свою камеру в поисках врага. Если есть совпадение, он разрезает вторгшуюся ДНК вдребезги. Некоторые бактерии хранят в своей базе данных ДНК до сотни фагов».
Crispr-Cas
Эта генетическая память бактерий также оказывается очень подходящей для работы с ДНК растения или животного (или человека). Точно так же, как бактерия ищет совпадение с ДНК бактериофага, генетики теперь используют то, что стало называться Crispr-cas, чтобы найти заранее запрограммированное положение в ДНК, чтобы выключить, исправить или заменить ген.
Броунс сыграл видную роль в исследованиях техники Crispr-cas. По его словам, это помогло ученым лучше изучить функцию генов. Выключив ген, вы увидите, на что больше не способна клетка или ткань. Это также полезно при исследовании бактерий и их фагов.
По сравнению с тем, что было несколько лет назад, читать генетический код бактерии или фага стало намного проще. В настоящее время вы готовы менее чем за сто евро. «Но тогда вы все равно не понимаете, что там написано», — говорит Браунс. «В этом отношении в микробиологии еще многое предстоит открыть. Огромное количество генетической информации хранится в базах данных по всему миру. Большую часть этого мы еще не понимаем. Или еще даже не смотрели. Какие белки кодируют эти гены? Что именно делают эти белки? Это плоды миллиардов лет эволюции, которыми можно воспользоваться. Но кто-то должен это увидеть».
Новые прорывы
Вполне возможно, что это приведет к новым прорывам. Несколько лет назад Браунс и его группа копались в такой базе данных ДНК. «Затем мы наткнулись на последовательность, о которой подумали: это может быть что-то. Что-то вроде банка памяти Crispr-cas. Так совпало, что у группы из Неймегена оказалась эта бактерия, чтобы мы могли исследовать ее функцию».
И действительно, это оказалось морганием. «Но он не разрезал ДНК вируса, как Crispr-cas, это был белковый резак. Обычно он был «выключен», но если к нему прилипал подходящий фрагмент вирусной РНК, он начинал резать. Белок Это совершенно другая молекула, чем ДНК, гораздо больше и сложнее. Трудно оценить, что мы можем с ней сделать. Но с тем, что у моргания есть потенциал, соглашаются все в этой области. как революция».
Цены Аммодо
Премия Ammodo Awards ежегодно вручается восемь исследователей в разных дисциплинах. В четные годы призы достаются командным исследованиям, а в нечетные — отдельным исследователям, выходящим за рамки текущих знаний и идей. В этом году лауреаты получат по 350 000 евро, которые они могут потратить на свои исследования по своему усмотрению.
Среди других победителей — Татьяна Филатова, которая ищет модель, которая влияние изменения климата на общество захватывает. Объединяя идеи, эти модели становятся еще ближе к реальному миру. Как показывают ее исследования потенциальных зон затопления. Прочитайте это интервью онлайн на сайте Trouw.nl/Wetenschap.
Читайте также:
2,5 миллиона евро на исследование бактерий, которые разрезают ДНК вируса на мелкие кусочки.
Его редко признают за его вклад в технику внесения изменений в ДНК. Джон ван дер Ост: «Разве это не мило, чувак!»
Фаготерапия: панацея от инфекций?
Может ли вирус спасти нас от устойчивых бактерий, как это увидел читатель по телевизору?